
Direttore di Produzione presso lo Stabilimento Fresenius Kabi iPSUM di Villadose (RO), che consta di quattro reparti di produzione a ciclo continuo, di cui un reparto di produzione di API orali e tre reparti di produzione di prodotti sterili, nei quali operano complessivamente un centinaio di operatori.
Fresenius Kabi iPSUM fa parte del gruppo Fresenius Kabi ed è leader nella produzione sterile cGMP di Principi Attivi Farmaceutici (API) beta-lattamici, sia per uso orale che sterile, fornendo oltre 50 prodotti diversi a più di 70 paesi, continuando a sviluppare la sua presenza nel campo delle penicilline e cefalosporine semisintetiche, con un focus principale sulla produzione sterile.
Le strutture all’avanguardia utilizzate nei diversi reparti produttivi di cui si compone lo stabilimento di Villadose sono approvate da tutte le principali autorità sanitarie, tra cui FDA, EDQM e AIFA.
Uno dei reparti sterili è dedicato alla produzione, attraverso due diverse linee produttive, di antibiotici in forma liofilizzata. La liofilizzazione, anche nota come crioessiccamento, è una tecnologia utilizzata per rimuovere l’acqua da prodotti sensibili e termolabili senza danneggiarli. Una volta liofilizzati, i prodotti possono essere conservati in maniera permanente ed essere successivamente ricostituiti reintegrando l’acqua.
Le lavorazioni nei reparti di produzione avvengono secondo le tradizionali operazioni unitarie tipiche dell’industria chimico-farmaceutica, che prevedono la dissoluzione delle materie prime, la sintesi, il work up, la filtrazione sterilizzante, la cristallizzazione e separazione dalle acque madri, l’essiccamento sotto vuoto.
Il processo di confezionamento prevede il trasferimento del solido essiccato in mixer, al fine di omogeneizzare il prodotto, il successivo trattamento di macinazione/micronizzazione a seconda delle specifiche richieste e, da ultimo, il packaging nell’imballaggio primario.


Tra le attività più significative intraprese vi è l’introduzione della Manufacturing Excellence nei reparti di produzione, di cui è riportato un maggiore dettaglio nella sezione del sito relativa ai progetti. Produrre di più, con il giusto timing, ottimizzando le risorse impiegate: la Lean Manufacturing è il paradigma per massimizzare i risultati dell’applicazione dei principi del Lean Thinking e delle metodologie del World Class Manufacturing.


Sono stato Responsabile di Produzione dello stabilimento Monico SpA di Mestre (VE), azienda farmaceutica italiana specializzata nella produzione di medicinali iniettabili e per infusione caratterizzata da un’ampia gamma di farmaci generici, soluzioni per terapie infusionali e per nutrizione parenterale, e di dispositivi medici, fondamentali nella cura di pazienti critici o affetti da malattie croniche.
In questo ruolo sono stato responsabile della continuità e della regolarità delle attività produttive e del conseguimento degli obiettivi prefissati in termini di volumi e tempi di produzione, del livello qualitativo, della corretta applicazione delle procedure operative e della tracciabilità delle operazioni che accompagnano i lotti di produzione.
L‘attività produttiva è condotta, in accordo con i requisiti definiti dalle Good Manufacturing Practices (GMP) e dal Sistema di Gestione della Qualità e Ambiente secondo le norme ISO 9001, ISO 13485 e ISO 14001.


Lo stabilimento si compone di quattro reparti: il Reparto Fiale (SVP, Small Volume Production), il Reparto Flaconi (LVP, Large Volume Production), il Reparto Sacche ed il Reparto Dispositivi Medici e, complessivamente, i reparti di produzione occupano circa 50 persone.
Il Reparto Fiale opera in semiturno producendo fiale nei formati da 1ml/2ml/5ml/10ml/20ml. La produzione si sviluppa attraverso le fasi di preparazione delle soluzioni, filtrazione e riempimento delle fiale con macchine automatiche, sterilizzazione termica in autoclave, sperlatura con macchine automatiche per il controllo della presenza di difetti (particellari, livello, cosmetici), stampa dei dati variabili sulla fiala o stampa e applicazione dell’etichetta sulla fiala, a seconda della specifica.
Il software di ispezione delle sperlatrici adotta strumenti di apprendimento automatico assistito (algoritmi di machine learning) che permettono una parametrizzazione accurata della natura dei difetti.
Il confezionamento impiega una macchina termoformatrice per i blister, un sistema pick&place per il posizionamento delle fiale nei blister, un’astucciatrice per l’inserimento dei blister negli astucci unitamente ai foglietti illustrativi, una macchina etichettatrice/serializzatrice degli astucci e un’inscatolatrice.


I Reparti Flaconi e Sacche operano invece in turno giornaliero realizzando, rispettivamente, flaconi nei formati da 100ml/250ml/500ml/1000ml e sacche nei formati da 100ml/250ml/500ml/1000ml/3000ml.
Il processo produttivo dei flaconi comprende la preparazione delle soluzioni, il lavaggio dei flaconi con l’impiego della macchina lavaflaconi, la filtrazione ed il riempimento automatico, la ghieratura con stampa dei dati variabili sulla ghiera, la sterilizzazione termica in autoclave, la sperlatura automatica, l’etichettatura e l’inscatolamento.
Il processo produttivo delle sacche è del tutto analogo fino alla fase di sterilizzazione termica in autoclave.


La fase di sperlatura delle sacche, invece, è visiva e condotta da operatori abilitati; i contenitori semirigidi usati per le soluzioni infusionali sono in polipropilene trasparente, in modo da consentirne il controllo del contenuto. Il materiale impiegato non è soggetto a cessioni nel tempo o durante il processo di sterilizzazione in autoclave ed è assolutamente impermeabile ai gas.
Il listino delle Soluzioni Iniettabili comprende oltre 150 prodotti, tra cui l’analgesico oppioide morfina cloridrato e l’antimuscarinico atropina solfato. Questo è il “core business” della compagnia. Il listino delle Soluzioni Infusionali comprende più di 100 prodotti, tra cui le soluzioni fisiologiche e quelle glucosate.
Monico produce anche per il settore Dispositivi Medici concentrati per emodialisi (Soluzioni Concentrate per Emodialisi con acetato, Soluzioni Concentrate per Emodialisi con bicarbonato, e Soluzioni Concentrate per Emodialisi da accoppiarsi a cartuccia di bicarbonato).

x

Ho lavorato in 3V Sigma Spa presso lo Stabilimento di Porto Marghera (VE) in qualità di Direttore di Produzione.
3V Sigma SpA produce e commercializza nel mondo un’ampia varietà di additivi e specialty chemicals per l’industria e detiene una posizione di leadership nei propri mercati grazie al costante sviluppo tecnologico, alla continua innovazione di prodotto e di processo, e alla politica di partnership con i principali clienti dei diversi settori di competenza: detergenza, cosmetica, tessile, carta, materie plastiche, coating, building & construction, trattamento acque, additivi di polimerizzazione.
x

In questo ruolo ho garantito, per i diversi impianti di cui si compone lo stabilimento di Porto Marghera eserciti con turnazione a ciclo continuo di 40 operatori, la continuità e la regolarità delle attività produttive ed il conseguimento degli obiettivi prefissati in termini di volumi e tempi di produzione, il livello qualitativo, dei costi variabili e fissi di produzione.
Sono stato garante della corretta applicazione delle norme di sicurezza sul lavoro, di igiene industriale e di tutela ambientale, verificandone il costante rispetto e assicurando l’aggiornamento dello sviluppo professionale e l’addestramento tecnico delle risorse assegnate, nonchè responsabile dell’ottimizzazione dell’impiego delle risorse tecniche ed umane assegnate.

La conduzione delle attività dello stabilimento, in quanto soggetto alla normativa grandi rischi (Direttiva Seveso III – D. Lgs. 26 Giugno 2015, N°105), era subordinata all’osservanza delle indicazioni contenute nel Sistema di Gestione della Sicurezza per la Prevenzione degli Incidenti Rilevanti (SGS), nel Sistema di Gestione Ambientale (SGA) conforme alla Norma Internazionale UNI EN ISO 14001:2004 e nel Sistema di Gestione della Sicurezza e Salute sul Lavoro (SG-SL) conforma ai requisiti della norma OHSAS 18001:2007.


‘


In FIS Fabbrica Italiana Sintetici, (che da gennaio 2017 ha acquisito Zach System, azienda chimico farmaceutica del gruppo Zambon precedente proprietaria dello stabilimento) ho assunto la responsabilità di uno dei reparti produttivi di intermedi e principi attivi farmaceutici (API) dello stabilimento di Almisano di Lonigo (Vicenza).
Lo stabilimento è soggetto alla normativa grandi rischi (Direttiva Seveso III – D. Lgs. 26 Giugno 2015, N°105 ex art. 8 D. Lgs. 334/99) e opera conformemente alle indicazioni contenute nei Sistemi di Gestione SGS, SGA e nel Sistema di Gestione della Sicurezza e Salute sul Lavoro (SG-SL).
Inoltre, detiene le autorizzazioni alla produzione e i Certificati di Conformità alle Norme di Buona Fabbricazione rilasciati dall’AIFA e FDA.
Il sito di Lonigo, che si estende su una superficie di 260.000 metri quadrati ha una capacità di produzione totale di 700 m3 in 3 unità di produzione indipendenti e di una unità di finitura dedicata all’essiccazione, macinazione, setacciatura, miscelazione, micronizzazione e al confezionamento di API.
‘
In questa posizione sono stato responsabile della continuità e della regolarità delle attività produttive del Reparto, dei volumi e dei tempi di produzione, del livello qualitativo, dei costi variabili e fissi di produzione, della corretta applicazione delle norme di buona fabbricazione (GMP) a tutela della qualità dei prodotti, nonché della corretta applicazione delle norme di sicurezza sul lavoro, di igiene industriale e di tutela ambientale.
Il reparto è costituito da 4 impianti multi-purpose, capaci cioè di essere “assemblati” in diverse configurazioni in modo da poter realizzare processi differenti, afferenti a prodotti differenti, gestiti da un sistema di controllo distribuito (Distributed Control System - DCS) con un’interfaccia uomo-macchina (HMI) che consente agli operatori di monitorare e controllare il processo in tempo reale.
Le operazioni, che coinvolgono 40 addetti su 3 turni a ciclo continuo, si sviluppano per gravità a partire dalla quota più elevata fino al piano terra e comprendono operazioni unitarie tipiche dell’industria chimico-farmaceutica: dissoluzione (carico materie prime, solventi e reattivi), sintesi, filtrazione, separazione di fase, concentrazione per distillazione batch sottovuoto, cristallizzazione, centrifugazione o trattamento in filtro essiccatore statico ed essiccamento.
Una esperienza significativa condotta in questo ruolo, è stata la progettazione del revamping dell’impianto di produzione dell’Acetilcisteina, sia sotto il profilo del design del processo che dell’automazione, del quale è riportato maggior dettaglio nella sezione del sito dedicata ai progetti.


‘

x

Ho lavorato come Project Manager in Zach System, azienda chimico farmaceutica del gruppo Zambon, presso lo stabilimento di Almisano di Lonigo (Vicenza).
In questa posizione ho assicurato la realizzazione degli investimenti affidatomi nel rispetto degli obiettivi fissati e delle procedure interne e normative in materia e garantendo che tutte le attività siano conformi alle norme di buona fabbricazione (GMP).
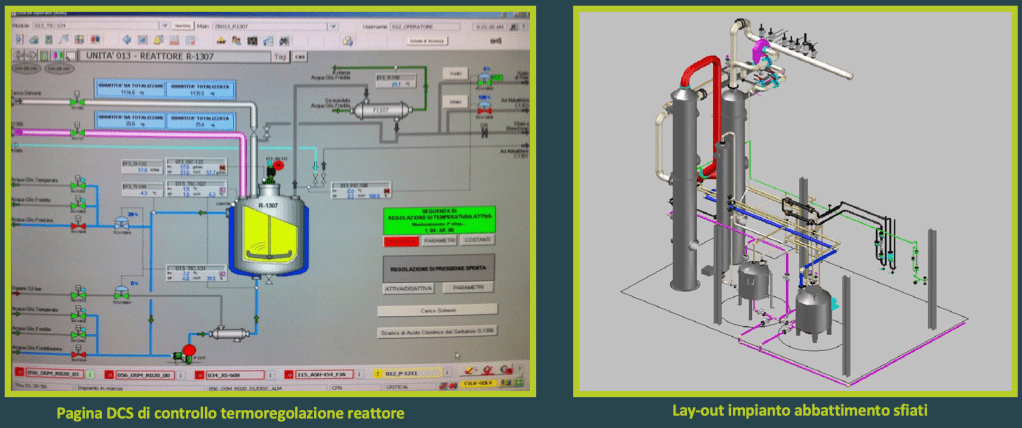
In particolare, ho svolto attività di elaborazione degli standard di ingegneria per i sistemi di termoregolazione dei reattori e dei sistemi di abbattimento delle emissioni dei reparti e di realizzazione degli investimenti contenuti nei piani di miglioramento dei reparti produttivi, dei quali sono riportatate maggiori informazione nella sezione del sito dedicata ai Progetti.

x


INEOS è uno dei maggiori produttori globali di specialità chimiche e petrolchimiche e di derivati del petrolio. Ne fanno parte 34 business, con una rete di produzione che si estende su 171 diversi siti industriali in 24 paesi del mondo, generando un volume di affari pari a circa 60 miliardi di dollari.
In INEOS ho ricoperto la posizione di Plant Manager presso lo stabilimento di Porto Marghera (Venezia) gestendo, con procura speciale a rappresentare la Società nei rapporti con l’Amministrazione dello Stato, le risorse umane, economiche e tecniche dell’impianto di produzione del PoliVinilCloruro (PVC), assicurando il raggiungimento degli obiettivi di budget in termini di volumi, qualità e costi.

Nel ruolo di Plant manager ho avuto, inoltre, la responsabilità di assicurare l’efficienza dell’impianto, attraverso la definizione dei livelli di manutenzione, e di garantire lo sviluppo tecnologico, proponendo azioni per il miglioramento delle performance produttive, qualitative, economiche e di sicurezza, salute e ambiente grazie al supporto offerto della funzione di Process Engineering, parte integrante della struttura organizzativa del plant.
L’esercizio dello stabilimento, soggetto ad Autorizzazione Integrata Ambientale, avviene conformemente ai requisiti imposti Sistema di Gestione Integrato QAS (Qualità, Ambiente e Sicurezza) il cui obbligo discende dalla natura a rischio di incidente rilevante dell’attività.
L’impianto, che si estende su una superficie di 44.000 mq, è organizzato su due linee di produzione della capacità complessiva di 170.000 t/a ed è gestito in continuo, tramite sistema di controllo DCS (Distribuited Control System), occupando un totale di 50 addetti. Ogni linea può essere suddivisa nelle sezioni di :
- polimerizzazione, composta da 6 reattori da 45 m3 glass lined e da un reattore da 80 m3 in acciaio inox;
- strippaggio, composta da due serbatoi da 250 m3 per lo stoccaggio dello slurry da strippare proveniente dalla sezione di polimerizzazione, una colonna di strippaggio a piatti forati ed un serbatoio dello slurry strippato da 50 m3;
- essiccamento, composta da due centrifughe, una linea di essiccamento a due stadi (flash e tamburo rotante) e una linea di setacciatura.
- stoccaggio prodotto finito, costituita da 6 silos da 250 m3 e 8 silos da 300 m3.
In questo ruolo ho anche avuto l’opportunità di essere Team Leader del gruppo di lavoro multi funzionale dedicato al progetto finalizzato alla riduzione dei costi fissi che ha permesso di ottenere significativi benefici in termini di saving ed aumento della produttività, riducendo alcune inefficienze e la frequenza dei guasti alle apparecchiature d’impianto.


x

Sono stato Engineering Manager in EVC European Vinyls Corporation (poi Ineos Vinyls) presso lo stabilimento Petrolchimico di Porto Marghera (Venezia) con la responsabilità dello svolgimento delle attività di ingegneria relative ai progetti di investimento nel sito, nel rispetto dei costi approvati e dei tempi di realizzazione previsti. In questo ruolo ho potuto acquisire esperienza nella gestione di progetti e di attività tipiche di ufficio tecnico realizzando investimenti per 11 M€ in 3 anni, principalmente finalizzati a recepire le modifiche impiantistiche suggerite dalla revisione del Rapporto di Sicurezza e dalle osservazioni del Comitato Tecnico Regionale.

‘

Assunto inizialmente in qualità di Supervisore Controllo Qualità, successivamente sono stato Responsabile di Produzione e Capo Officina presso I.M.S. Industrie Meccaniche Scardellato S.p.A, società di progettazione e realizzazione di apparecchiature ed impianti per l’industria chimica e petrolchimica.
Dopo un’attività per il supporto all’avviamento di una sezione di impianto di separazione, disidratazione ed iniezione gas, nell’ambito del “Sahil Field Development Project” (Saipem-Snamprogetti-ADCO) presso Sahil (Abu Dhabi – Emirati Arabi Uniti) di cui IMS è stato subfornitore, mi è stata affidata la responsabilità della produzione dello Stabilimento.
